Pengertian dan Jenis-jenis Ikatan Kovalen
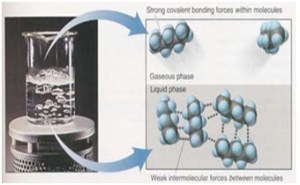 Ikatan Kovalen adalah ikatan yang terjadi karena pemakaian pasangan elektron secara bersama oleh 2 atom yang berikatan. Ikatan kovalen terjadi akibat ketidakmampuan salah 1 atom yang akan berikatan untuk melepaskan elektron (terjadi pada atom-atom non logam).
Ikatan Kovalen adalah ikatan yang terjadi karena pemakaian pasangan elektron secara bersama oleh 2 atom yang berikatan. Ikatan kovalen terjadi akibat ketidakmampuan salah 1 atom yang akan berikatan untuk melepaskan elektron (terjadi pada atom-atom non logam).
Pembentukan ikatan kovalen terbentuk dari atom-atom unsur yang memiliki afinitas elektron tinggi serta beda keelektronegatifannya lebih kecil dibandingkan ikatan ion. Atom non logam cenderung untuk menerima elektron sehingga jika tiap-tiap atom non logam berikatan maka ikatan yang terbentuk dapat dilakukan dengan cara mempersekutukan elektronnya dan akhirnya terbentuk pasangan elektron yang dipakai secara bersama. Pembentukan ikatan kovalen dengan cara pemakaian bersama pasangan elektron tersebut harus sesuai dengan konfigurasi elektron pada unsur gas mulia yaitu 8 elektron (kecuali He berjumlah 2 elektron). (lebih…)